Sebelum membahas lebih lanjut tentang hibridisasi dan bagian-bagiannya, kita terlebih dahulu mengetahui tentang sejarah dan pengertiannya. Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
Hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul.
Teori hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
Pembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
Pembentukan ikatan dalam senyawa harus sesuai dengan aturan hibridisasi yaitu :
- Orbital yang bergabung harus mempunyai tingkat energi sama atau hampir sama
- Orbital hybrid yang terbentuk sama banyaknya dengan orbital yang bergabung.
- Dalam hibridisasi yang bergabung adalah orbital bukan electron
- Salah satu electron yang berpasangan berpromosi ke orbital yang lebih tinggi tingkat energinya sehingga jumlah electron yang tidak berpasangan sama dengan jumlah ikatan yang akan terbentuk. Atom yang sedemikian disebut dalam keadaan tereksitasi. Promosi yang mungkin adalah dari ns ken p dan ns ke ns ke nd atau (n-1)d
- Penggabungan orbital mengakibatkan kerapatan electron lebih besar di daera orbital hybrid.
- Terjadi tumpang tindih orbital hybrid dengan orbital atom lain sehingga membentuk ikatan kovalen atau kovalen koordinasi.
Beberapa jenis hibridisasi orbital
Disini akan dijelaskan hibridisasi SP, SP2,SP3
1. Hibridisai SP
Salah satu contoh orbital sp terjadi pada Berilium diklorida. Berilium mempunyai 4 orbital dan 2 elektron pada kulit terluar. Pada hibridisasi Berilium dijelaskan bahwa orbital 2s dan satu orbital 2p pada Be terhibridisasi menjadi 2 orbital hibrida sp dan orbital 2p yang tidak tribridisasi. Hibridisasi sp membentuk geometri linear dengan sudut 180.
2. Hibridisasi sp2
Salah satu contoh orbital hirbid sp2 diasumsikan terjadi pada Boron trifluorida. Boron mempunyai 4 orbital tapi hanya 3 eletron pada kulit terluar. Hibridisasi boron mengkombinasikan 2s dan 2 orbital 2p menjadi 3 orbital hybrid sp2 dan 1 orbital yang tidak mengalami hibridisasi. Orbital hybrid sp2 menjadi bentuk trigonal planar dengan sudut ikatan120.
3. Hibridisasi sp3
Hibridisasi satu orbital s dan tiga orbital p, membentuk orbital hibrida sp3 yang strukturnya tetrahedral. Sudut ikatan dengan orbital ini mendekati 109028’.
IKATAN RANGKAP TERKONJUGASI
Ikatan rangkap terkonjugasi adalah ikatan antar atom yang terjadi pada senyawa organik dan secara kovalen ikatan antar atomnya ialah ikatan rangkap dua dan tunggal bergantian, dimana terjadi delokalisasi elektron agar tingkat energinya lebih stabil. misalnya pada ikatan C-C dan C-O tingkat kestabilan ikatan C-O lebih kuat karena atom O akan menyumbangkan elektron kepada atom C sehingga keelektronegatifan dan afinitas antar atom menjadi lebih kuat. Sistem konjugasi secara umumnya akan menyebabkan delokalisasi elektron di sepanjang orbital p yang paralel satu dengan sama lainnya. Hal ini akan meningkatkan stabilitas dan menurunkan energi molekul secara keseluruhan. Pengaturan kembali electron melalui orbital π, terutama dalam system konjugasi atau senyawa organic yang atom-atomnya secara kovalen berikatan tunggal dan ganda secara bergantian (C=C-C=C-C) dan mempengaruhi satu sama lainnya membentuk daerah delokalisasi electron disebut dengan konjugasi. Elektron-elektron pada daerah delokalisasi ini bukanlah milik salah satu atom, melainkan milik keseluruhan system konjugasi ini.
BENZENA DAN RESONANSI
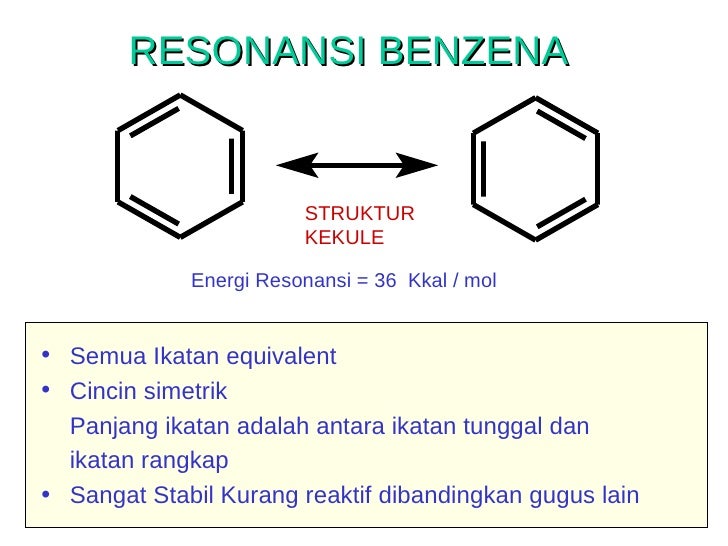
Benzena ialah suatu senyawa siklik yang elektronnya terkonjugasi. Benzena jika direaksikan dengan Br2 tidak dapat bereaksi.Benzena baru bisa dibrominasi dengan menggunakan asam lewis misalnya FeBr2.Mengapa direaksikan dengan katalis asam Lewis yakni dengan menggunakan FeBr3 sebagai katalis, karena dari teori, asam Lewis yang dapat membantu Br masuk kedalam ikatan benzena . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta. Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.

Benzena ialah suatu senyawa siklik yang elektronnya terkonjugasi. Benzena jika direaksikan dengan Br2 tidak dapat bereaksi.Benzena baru bisa dibrominasi dengan menggunakan asam lewis misalnya FeBr2.Mengapa direaksikan dengan katalis asam Lewis yakni dengan menggunakan FeBr3 sebagai katalis, karena dari teori, asam Lewis yang dapat membantu Br masuk kedalam ikatan benzena . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta. Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.


Assalamualaikum Winarsih
BalasHapusSaya hanya ingin menambahkan sedikit dari Artikel anda bahwa Hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul. Konsep ini adalah bagian tak terpisahkan dari teori ikatan valensi.
Terimakasih