PERTANYAAN
1. Jelaskan mengapa suatu sikloheksana terdisubstitusi-cis-1,3 lebih stabil daripada struktur-trans-padanannya?
JAWAB :
Sikloheksana merupakan sikloalkana yang dikategorikan seebagai hidrokarbon alisiklik dengan rumus umum CnH2n . dua gugus yang disubstitusikan pada suatu cincin sikloheksana dapat bersifat cis maupun trans. Konformasi sikloheksana yang paling stabil adalah konformasi kursi (chair conformation) karena sudutnya mendekati 109 0 (sudut ikatan C-C-C adalah 111 0 ). Konformasi kursi ditandai oleh adanya dua macam orientasi ikatan C-H , yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H ekuatorial. Konformasi selain kursi, cenderung tidak stabil. Jika satu atom H pada sikloheksana diganti gugus –CH3 atau gugus lain, maka gugus –CH3 atau gugus lain tersebut dapat berposisi aksial ataupun ekuatorial. Dalam hal ini konformasi yang lebih stabil adalah konformasi dengan gugus –CH3 berposisi ekuatorial.
Molekul sikloheksana dapat bersifat cis ataupun trans bila tersubstitusi oleh dua gugus molekul atau atom. Bentuk cis dan trans pada sikloheksana adalah isomer geometris dan pada suhu kamar tak dapat saling diubah satu menjadi lainnya, dan masing-masing isomer dapat memiliki aneka ragam konformasi.
Jadi, intinya Karena kedua subtituennya dapat berposisi ekuitorial. Tetapi bila kedua subtituen itu 1,3 satu terhadap yang lain pada suatu cincin sikloheksana, maka cis-isomer lebih stabil daripada trans. Karena kedua subtituen dalam 1.3-isomer, dapat berposisi ekuatorial. Dalam trans, 1 gugus terpaksa berposisi aksial. Dalam hal ini kestabilan suatu isomer baik cis maupun trans tergantung pada posisi subtituennya. Jika cis-1,3 lebih stabil dikarenakan posisi ekuatorial hal ini dikarenakan posisi ekuatorial efk tolakan steriknya lebih kecil dibandingkan posisi aksial pada trans-1,3.
2. Tuliskan Proyeksi Fischer untuk semua konfigurasi yang mungkin dari 2,3,4-pentanatriol. Tunjukkan pasangan-pasangan enantiomernya?
JAWAB :
Minggu, 09 Oktober 2016
Jumat, 07 Oktober 2016
KONFIGURASI RELATIF DAN KONFIGURASI MUTLAK
Sedikit membahas yaitu tentang pengertian dari konfigurasi itu sendiri dimana konfigurasi memiliki arti yaitu suatu pembentukan susunan setingan atau proses pembuatan wujud dari sebuah benda. Dimana pada penggunaannya konfigurasi biasanya digunakan dengan penambahan kata yang kemudian akan memperjelas arti kata konfigurasi itu sendiri.
Kemudian Enantiomer (dalam bahasa Yunani enantio berarti berlawanan/ opposite ) adalah molekul bayangan cermin yang tidak dapat dihimpitkan. Jika suatu molekul tidak dapat dihimpitkan dengan bayangan cerminnya berarti kedua senyawa enantiomer disebut kiral/ chiral (ky-ral dalam bahasa Yunani cheir, berarti “tangan”).
Molekul yang tidak kiral jika mengandung sisi simetri (plane of chemistry ). Sisi simetri yang dimaksud adalah sisi datar yang dipotong melewati tengah-tengah dari molekul. Kiral sudah pasti asimetrik namun asimetrik belum tentu kiral.
1. KONFIGURASI RELATIF
relatif yaitu berarti tidak mutlak atau nisbi dimana sesuatu hanya dapat dinilai atau diukur jika hanya ada pembanding atau acuan.
Sedangkan pengertian konfigurasi relatif itu sendiri adalah dimana dikatakan relatif karena cara penentuannya didasarkan pada perbandingan dengan senyawa pembanding. Dalam menggamabarkan sturktur proyeksi fischer harus memperhatikan beberpa aturan, antara lain : gugus-gugus yang diletakkan horizontal adalah gugus-gugus yang mendekati pengamat. Gugus-gugus yang diletakkan vertikal adalah gugus-gugus yang menjauhi pengamat. Hetero atom (atom selain C dan H) diletakkan diatas.
Orientasinya D dan L Arah orientasi D adalah searah jarum jam, sedangkan arah orientasi L adalah berlawanan jarum jam.
2. KONFIGURASI MUTLAK
Pengertian mutlak adalah sepenuhnya atau seutuhnya dan tidak tergantung pada kondisi apapun sebagai syarat.
Konfigurasi mutlak itu sendiri memiliki arti yaitu penataan atom-atom dalam ruanf tiga dimensi dalam orientasi yang sudah pasti atau suatu susunan kelompok tentang atom asimetris dan terutama sebuah atom tetrahedrally terikat dengan empat substituent yang berbeda-beda. Urutan penataan keempat gugus disekitar suatu atom karbon kiral sering disebut dengan konfigurasi mutlak di atom itu. Konfigurasi mutlak dalam suatu enantiomer adalah khas struktur dari molekulnya. Dan tak terdapat hubungan yang sederhana diantara konfigurasi mutlak di suatu enantiomer tertentu atau arah pemutarannya di bidang polarisasi cahaya olehnya. Konfigurasi mutlak ( + ).
Konfigurasi mutlak menggunakan arah orientasi R (rectus) dan S (sinister) untuk setiap pusat kiral dalam molekul dan merupakan pilihan untuk menentukan konfigurasi pusat kiral molekul obat . Penentuan pusat gugus yang melekat pada pusat kiral berdasarkan nomor atom yang bersangkutan. Arah orientasi R adalah searah jarum jam, sedangkan arah orientasi S adalah berlawanan jarum jam. Cara penentuan konfigurasi R dan S berdasarkan ketentuan Chan-Ingold-Prelog
• Urutkan prioritas keempat atom yang terikat pada pusat kiral berdasarkan nomor atomnya. Diketahui nomor atom Br = 35, Cl = 17, F = 9, H = 1, maka urutan prioritas keempat atom di atas adalah Br > Cl > F > H.
• Gambarkan proyeksi molekul sedemikian rupa hingga atom dengan prioritas terendah ada di belakang atau putar struktur (1) dan (2) sehingga atom H ada di belakang.
• Buat anak panah mulai dari atom/gugus berprioritas paling tinggi ke prioritas yang lebih rendah.
• Bila arah anak panah searah jarum jam, konfigurasinya adalah R. Bila arah anak panah berlawanan dengan arah jarum jam, konfigurasinya adalah S. Jadi konfigurasi struktur (1) adalah S, sedangkan konfigurasi struktur (2) adalah R.
Kemudian Enantiomer (dalam bahasa Yunani enantio berarti berlawanan/ opposite ) adalah molekul bayangan cermin yang tidak dapat dihimpitkan. Jika suatu molekul tidak dapat dihimpitkan dengan bayangan cerminnya berarti kedua senyawa enantiomer disebut kiral/ chiral (ky-ral dalam bahasa Yunani cheir, berarti “tangan”).
Molekul yang tidak kiral jika mengandung sisi simetri (plane of chemistry ). Sisi simetri yang dimaksud adalah sisi datar yang dipotong melewati tengah-tengah dari molekul. Kiral sudah pasti asimetrik namun asimetrik belum tentu kiral.
1. KONFIGURASI RELATIF
relatif yaitu berarti tidak mutlak atau nisbi dimana sesuatu hanya dapat dinilai atau diukur jika hanya ada pembanding atau acuan.
Sedangkan pengertian konfigurasi relatif itu sendiri adalah dimana dikatakan relatif karena cara penentuannya didasarkan pada perbandingan dengan senyawa pembanding. Dalam menggamabarkan sturktur proyeksi fischer harus memperhatikan beberpa aturan, antara lain : gugus-gugus yang diletakkan horizontal adalah gugus-gugus yang mendekati pengamat. Gugus-gugus yang diletakkan vertikal adalah gugus-gugus yang menjauhi pengamat. Hetero atom (atom selain C dan H) diletakkan diatas.
Orientasinya D dan L Arah orientasi D adalah searah jarum jam, sedangkan arah orientasi L adalah berlawanan jarum jam.
2. KONFIGURASI MUTLAK
Pengertian mutlak adalah sepenuhnya atau seutuhnya dan tidak tergantung pada kondisi apapun sebagai syarat.
Konfigurasi mutlak itu sendiri memiliki arti yaitu penataan atom-atom dalam ruanf tiga dimensi dalam orientasi yang sudah pasti atau suatu susunan kelompok tentang atom asimetris dan terutama sebuah atom tetrahedrally terikat dengan empat substituent yang berbeda-beda. Urutan penataan keempat gugus disekitar suatu atom karbon kiral sering disebut dengan konfigurasi mutlak di atom itu. Konfigurasi mutlak dalam suatu enantiomer adalah khas struktur dari molekulnya. Dan tak terdapat hubungan yang sederhana diantara konfigurasi mutlak di suatu enantiomer tertentu atau arah pemutarannya di bidang polarisasi cahaya olehnya. Konfigurasi mutlak ( + ).
Konfigurasi mutlak menggunakan arah orientasi R (rectus) dan S (sinister) untuk setiap pusat kiral dalam molekul dan merupakan pilihan untuk menentukan konfigurasi pusat kiral molekul obat . Penentuan pusat gugus yang melekat pada pusat kiral berdasarkan nomor atom yang bersangkutan. Arah orientasi R adalah searah jarum jam, sedangkan arah orientasi S adalah berlawanan jarum jam. Cara penentuan konfigurasi R dan S berdasarkan ketentuan Chan-Ingold-Prelog
• Urutkan prioritas keempat atom yang terikat pada pusat kiral berdasarkan nomor atomnya. Diketahui nomor atom Br = 35, Cl = 17, F = 9, H = 1, maka urutan prioritas keempat atom di atas adalah Br > Cl > F > H.
• Gambarkan proyeksi molekul sedemikian rupa hingga atom dengan prioritas terendah ada di belakang atau putar struktur (1) dan (2) sehingga atom H ada di belakang.
• Buat anak panah mulai dari atom/gugus berprioritas paling tinggi ke prioritas yang lebih rendah.
• Bila arah anak panah searah jarum jam, konfigurasinya adalah R. Bila arah anak panah berlawanan dengan arah jarum jam, konfigurasinya adalah S. Jadi konfigurasi struktur (1) adalah S, sedangkan konfigurasi struktur (2) adalah R.
Jumat, 30 September 2016
STEREOKIMIA
Perlu diketahui bahwa stereokimia sangatlah penting, bahkan karena stereokimia ini, sebuah struktur yang memiliki rumus molekul sama hanya karena susunannya berbedaakan mengakibatkan fungsi yang berbeda pula. Stereokimia adalah studi mengenai molekul-molekul dalam ruang tiga dimensi yakni, bagaimana atom-atom dalam sebuah molekul ditata dalam ruangan satu relative terhadap yang lain. Stereokimia berbeda dengan isomer struktural, stereokimia memiliki posisi suatu rumus molekulnya tetap namun orientasi arahnya yang berbeda. Sedangkan isomer struktural ialah molekul yang memiliki rumus molekul sama tetapi memiliki pengaturan atau struktur yang berbeda dari atom dalam ruang.
Misal :
H H
H H
posisi H tidak saling berhadapan, jika berhadapan energinya lebih besar dari pada tidak berhadapan ataupun saling tolak menolak.
VARIASI STRUKTUR SENYAWA ORGANIK
1. Variasi jenis dan jumlah atom penyusun molekul
2. Variasi urutan atom yang terikat satu sama lain dalam suatu molekul
3. Variasi penataan atom peyusun molekul dalam ruang 3 dimensi yang dikarenakan ketegaran (rigidity) dalam molekul.
JENIS ISOMER
1. Isomer Struktural
• Jenis dan jumlah penyusun molekul sama
• Variasi urutan atom yang terikat satu sama lain dalam suatu molukul gugus fungsi sama, beda urutan atom saja
• Gugus fungsi beda (isomer fungsional)
2. Isomer Geometrik
Orientasi molekul nya tetap pada posisi, tetapi boleh menghadap kemana saja
• Jenis, jumlah dan urutan yang terkait antara satu sama lain dalam suatu molekul sama
• Variasi penataan atom penyusun dalam ruang 3 dimensi yang dikarenakan ketegaran (rigidity) dalam molekul.
Macam-macam isomer geometric
- Isomer geometric pada hidrokarbon tak jenuh rantai terbuka
- Isomer geometric pada hidrokarbon jenuh rantai terbuka
- Isomer geometric pada hidrokarbon siklik
- Isomer geometric pada hidrokarbon yang mempunyai pusat kiral ( atom c yang terikat memiliki jenis yang berbeda-beda atau mengikat atom yang berbeda).
ISOMER GEOMETRI PADA HIDROKARBON TAK JENUH RANTAI TERBUKA
Keterbatasan perputaran atom-atom yang terikat pada masing-masing atom C pada ikatan rangkap yang dikarenakan adanya interaksi antara orbital p membentuk ikatan phi.
ͽ Isomer geometric is dan trans
ͽ Isomer geometri E dan Z
ͽ Ikatan tunggal : pergerakannya lebih leluasa (atom H)
ͽ Ikatan rangkap : pergerakan atom H terhambat karena ada ikatan phi
SISTEM DAN TATANAMA CIS DAN TRANS
- Cis : pada posisi yang sama (sejajar)
- Trans : bersebrangan
Contoh :
Chan-Ingold-Prelog
Atom dengan nomor atom lebih tinggi mempunyai prioritas lebih tinggi
- Isotope dengan nomor massa lebih tinggi menjadi prioritas
- Atom dengan ikatan rangkap 2 atau 3 setara dengan 2 atau 3 kali ikatan tunggal
Kamis, 22 September 2016
ISOMER STRUKTUR SENYAWA KARBON
Isomer adalah
suatu keadaan di mana dua senyawa atau lebih yang mempunyai rumus molekul
kimia yang sama, tetapi mempunyai struktur yang berbeda.
Senyawa
karbon yang paling sederhana adalah hidrokarbon karena hanya terdiri dari dua
unsur, yaitu karbon (C) dan hidrogen (H). Meskipun demikian jumlah senyawa yang
dihasilkan dari kedua unsur ini sangat banyak. Macam – macam atom karbon, yaitu
atom karbon primer, sekunder, tersier, dan kuarterner. Keistimewaan atom karbon
yang dapat membentuk ikatan kovalen sebanyak 4 buah dan kemampuannya dalam
membentuk rantai karbon, menyebabkan atom karbon mempunyai kedudukan y ang
berbeda-beda. Kedudukan tersebut adalah:
1.
Atom karbon primer, yaitu
atom karbon yang terikat langsung pada 1 atom karbon yang lain.
2.
Atom karbon sekunder, yaitu
atom karbon yang terikat langsung pada 2 atom karbon yang lain.
3.
Atom karbon tersier, yaitu
atom karbon yang terikat langsung pada 3 atom karbon yang lain.
4.
Atom karbon kuarterner, yaitu atom karbon yang terikat langsung pada 4
atom karbon yang lain.

Dari contoh di atas, bisa dilihat jumlah atom
karbon pada masing-masing posisi,yaitu:
primer
: 5 (yang bertanda 1°)
sekunder : 3
(yang bertanda 2°)
tersier
: 1 (yang bertanda 3°)
kuarterner : 1 (yang
bertanda 4°)
Banyaknya kemungkinan struktur senyawa karbon,
menyebabkan perlunya pemberian nama yang dapat menunjukkan jumlah atom C dan
rumus strukturnya. Aturan pemberian nama hidrokarbon telah dikeluarkan oleh
IUPAC atau yang disebut dengan
sistem nomenklatur IUPAC (International Union of Pure and Applied
Chemistry), yang terdiri dari 3 bagian yaitu: : Prefix (awalan cabang dengan akhiran -il), Parent (jumlah atom karbon pada rantai utama
(terpanjang)), Suffix (akhiran).
Contoh :
è suffix (ana) dan parent 5
R-Mg-X è prefix (Mg), parent (R=gugus alkil), dan suffix (X=halida)
Jenis-jenis
isomer struktur
1. Isomer Rangka
Isomer rangka adalah isomeri yang terjadi karena
perbedaan rangkanya, biasanya terjadi antara senyawa rantai lurus dengan
senyawa yang memiliki cabang, bisa pula antar senyawa yang memiliki cabang,
namun berbeda pada posisi dan jumlah cabang.
Contoh :
Cloro Butana jika direaksikan akan menata ulang dan membentuk produk yang lebiha banyak, cloro butana lebih mudah disubtitusi karena letak subtituen paling ujung dan bersifat tidak stabil. Sedangkan 2-cloro butana lebih stabil. Kestabilan dilihat dari atom H yang paling banyak.
2. Isomer Posisi
Isomer posisi adalah isomeri yang terjadi karena
perbedaan posisi ikatan rangkap. Isomeri ini hanya terjadi pada senyawa
hidrokabon tak jenuh (alkena dan alkuna).
Contoh:
3. Isomer Fungsional
Isomer fungsional adalah isomer yang berbeda golongan.
Keisomeran fungsi terjadi karena perbedaan gugus fungsi diantara senyawa yang
mempunyai rumus molekul sama.
Contoh
:
C-C-OH C-O-C
sifat fisisnya titih didih etanol lebih tinggi dari dimetil eter, sedangkan dari segi sifat kimianya etanol lebih reaktif dari dimetil eter sehingga lebih mudah bereaksi karena kepolaran senyawa etanol sedangkan dimetil eter bersifat non polar.
ETILENA
Etena atau etilena adalah senyawa alkena paling sederhana yang terdiri dari empat
atom hidrogen dan dua
atom karbon yang terhubungkan oleh suatu ikatan rangkap. Karena ikatan rangkap ini, etena disebut pula hidrokarbon
tak jenuh atau olefin.
Pada suhu kamar,
molekul etena tidak dapat berputar pada ikatan rangkapnya sehingga semua atom
pembentuknya berada pada bidang yang sama. Sudut yang dibentuk oleh dua ikatan
karbon-hidrogen pada molekul adalah 117°, sangat dekat dengan sudut 120° yang
diperkirakan berdasarkan hibridisasi ideal
sp2.
Yang
perlu diperhatikan adalah :
§ Panjang ikatan
§ Sudut ikatan
Panjang ikatan
rangkap lebih pendek dibanding ikatan tunggal hal ini dikarenakan interaksi
antara ikatan pi
menyebabkan panjang ikatan memendek.
PERTANYAAN
Mengapa sudut ikatan H-C-C (sudut ikatannya=121) lebih
besar dibanding sudut ikatan H-C-H (sudut ikatannya=117) ?
Jawab :
Sudut ikatan H-C-C lebih besar dari sudut ikatan
H-C-H, karena elektron valensi atom pusat yang digunakan pada pembentukan
senyawa kovalen terkadang digunakan untuk membentuk ikatan kadang tidak
digunakan. Elektron yang tidak digunakan digunakan ditulis sebagai pasangan
elektron bebas (PEB). Sedangkan electron yang digunakan dalam pembentukan
ikatan ditulis sebagai pasangan electron ikatan (PEI). Selain PEB dan PEI pada
atom pusat dapat pula terdapat electron tidak berpasangan seperti molekul NO2.Dalam
suatu molekul elektron-elektron tersebut saling tolak-menolak karena memiliki
muatan yang sama. Untuk mengurangi gaya tolak tersebut atom-atom yang berikatan
membentuk struktur ruang tertentu hingga tercapai gaya tolak yang minimum.
Akibat yang ditimbulkan dari tolakan yang terjadi yaitu mengecilnya sudut
ikatan dalam molekul.
Jumat, 16 September 2016
KLASIFIKASI SENYAWA ORGANIK
Senyawa organik adalah senyawa yang banyak mengandung unsur karbon dan unsur lainnya seperti hidrogen, oksigen, nitrogen, belerang, dan fosfor dalam jumlah sedikit. Ada jutaan senyawa organik dan untuk mempermudah dalam mempelajarinya, senyawa organik diklasifikasikan kedalam berbagai kelompok dan sub kelompok. Secara umum, senyawa organik dikategorikan sebagai berikut:
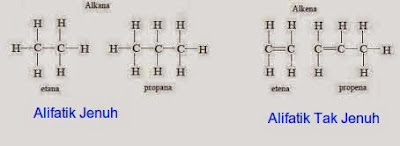
SENYAWA RANTAI TERBUKA
Senyawa ini mengandung sistem rantai terbuka dari atom karbon. Rantai dapat berupa rantai lurus (tidak bercabang), atau bercabang. Senyawa rantai terbuka disebut senyawa alifatik. Alifatik berasal dari bahasa Yunani Aleiphar yang berarti lemak, sebagaimana senyawa ini sebelumnya diperoleh dari lemak hewani atau nabati
Senyawa alifatik dibedakan menjadi :
- Hidrokarbon jenuh/tersaturasi adalah hidrokarbon yang paling sederhana. Hidrokarbon ini seluruhnya terdiri dari ikatan tunggal dan terikat dengan hidrogen. Rumus umum untuk hidrokarbon tersaturasi adalah CnH2n+2.Hidrokarbon jenuh merupakan komposisi utama pada bahan bakar fosil dan ditemukan dalam bentuk rantai lurus maupun bercabang. Hidrokarbon dengan rumus molekul sama tapi rumus strukturnya berbeda dinamakan isomer struktur.
- Hidrokarbon tak jenuh/tak tersaturasi adalah hidrokarbon yang memiliki satu atau lebih ikatan rangkap, baik rangkap dua maupun rangkap tiga. Hidrokarbon yang mempunyai ikatan rangkap dua disebut dengan alkena, dengan rumus umum CnH2n.Hidrokarbon yang mempunyai ikatan rangkap tiga disebut alkuna, dengan rumus umum CnH2n-2.
Hidrokarbon alkana, alkena dan alkuna adalah senyawa alifatik, seperti asam lemak dan banyak senyawa lainnya. Kebanyakan senyawa yang mengandung cincin adalah senyawa aromatik. Dengan demikian, senyawa alifatik adalah kebalikan dari senyawa aromatik.
AlkanaAlkana merupakan hidrokarbon alifatik jenuh. Kelompok senyawa ini sering disebut parafin karena sifatnya yang kurang reaktif. (Parafin berasal dari kata “parum” berarti sedikit, dan “affinis” berarti gabung; atau “parum affinis” yang berarti “berdaya gabung kecil”.) Semua senyawa alkana memiliki rumus umum CnH2n+2 dimana n adalah jumlah atom karbon. Senyawa alkane yang paling sederhana adalah metana (CH4). Seluruh atom H membentuk 4 ikatan sigma pada satu atom karbon, mengalami hibridisasi sp3 dengan bangun molekul tetrahedral.
AlkenaAlkena atau olefin dalam kimia organik adalah hidrokarbon tak jenuh dengan sebuah ikatan rangkap dua antara atom karbon. Alkena asiklik yang paling sederhana, yang membentuk satu ikatan rangkap dan tidak berikatan dengan gugus fungsional manapun, maka akan membentuk suatu kelompok hidrokarbon dengan rumus umum CnH2n.Alkena yang paling sederhana yakni adalah atena (C2H4). Membentuk 3 ikatan sigma dan 1 ikatan pi yang terjadi pada satu atom karbon dan memiliki hibridisasi sp2
Alkuna
Alkuna merupakan deret senyawa hidrokarbon tidak jenuh yang dalam tiap molekulnya mengandung satu ikatan rangkap 3 diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap 3 atau 3 ikatan kovalen diperlukan 6 elektron, sehingga tinggal satu elektron pada tiap-tiap atom C tersisa untuk mengikat atom H. Jumlah atom H yang dapat diikat berkurang dua, sehingga rumus umumnya menjadi : CnH2n+2 - 4H = CnH2n-2
Alkuna yang paling sederhana adalah metuna (C2H2). Membentuk 2 ikatan sigma dan 2 ikatan pi dalam satu atom karbonnya dan memiliki hibridisasi sp.
SENYAWA RANTAI TERTUTUP
Senyawa ini mengandung satu atau lebih rantai tertutup (cincin) dan dikenal sebagai senyawa siklik, terdiri dari dua jenis:
1. Senyawa Homosiklik
Senyawa-senyawa dimana cincin hanya terdiri dari atom carbon. Senyawa homosiklik atau senyawa karbosiklik dibagi menjadi senyawa alisiklik dan senyawa aromatik.
- · Senyawa alisiklik
Merupakan Sebuah cincin beranggota tiga atau lebih atom karbon menyerupai senyawa alifatik seperti dalam senyawa homosiklik. Hidrokarbon alisiklik jenuh memiliki rumun umum CnH2n.
- Senyawa Aromatik
Senyawa ini mengandung cincin benzena yaitu sebuah cincin dari enam atom karbon dengan ikatan ganda dan tunggal yang berselang seling. Disebut senyawa aromatik karena sebagian darinya memiliki bau yang harum

2. Senyawa Heterosiklik
Ialah ketika lebih dari satu jenis atom berada dalam satu senyawa cincin. Dalam senyawa ini umumnya satu atau lebih atom unsur seperti Nitrogen, Oksigen, atau Sulfur ada di dalam cincin. Atom selain karbon yang ada di dalam cincin disebut heteroatom. Senyawa heterosiklik selanjutnya dapat diklasifikasikan sebagai monosiklik, bisiklik dan trisiklik tergantung pada jumlah atom penyusun cincin satu, dua dan tiga.

Langganan:
Postingan (Atom)